| עמוד הבית | | | דבר העורכת | | | הכוח הנשי | | | אופנה | | | מבצעים | | | עסקים וקריירה | | | הורים וילדים | | | תרבות ובידור | | | צרכנות |
| אלטרנטיבי | | | יופי וטיפוח | | | חברה וקהילה | | | חדשות | | | עיצוב | | | ספורט וכושר | | | תזונה ודיאטה | | | תאווה לחיך | | | תיירות |
| יצירת קשר |
|
|
סוכנות התרופות האירופית אישרה תרופה חדשה לסרטן השד
מאת: מערכת Iwomen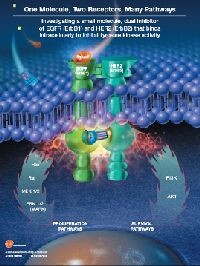
בימים הקרובים תוגש לדיוני הועדה הציבורית להרחבת סל התרופות לשנת 2009
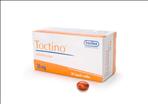
סוכנות התרופות האירופאית ה- EMEA, אישרה אמש לחברת התרופות גלקסו סמית קליין (GSK) לשווק את טייקרב (Tykerb), תרופה חדשה הניתנת ללקיחה בבליעה לטיפול בסרטן שד מתקדם או גרורתי, בשילוב עם כימותרפיה, ב – 27 מדינות החברות באיחוד האירופי. האישור ניתן בעקבות קבלת תוצאות מעודדות של ניסויים קליניים, שחלקם אף התקיימו בישראל, אשר הראו שיפור בסיכויי הישרדות בחולות סרטן השד. התרופה ניתנת בצורת כדורים והטיפול אינו מצריך אשפוז או עירוי. מדובר בתרופה ביולוגית ממוקדת מטרה, שהחומרים הפעילים בה תוקפים באופן ישיר רק את הקולטנים בתוך התא הסרטני ואינם פועלים על תאים אחרים כמו בטיפול כימותרפי.
בימים הקרובים תוגש התרופה לדיוני הועדה הציבורית להרחבת סל התרופות לשנת 2009, אשר תקציבה עומד על 425 מיליון שקלים וחברים בה פרופ' מנחם פיינרו, המכהן כיו"ר, ד"ר אסנת לוקסנבורג, ראש המינהל לטכנולוגיות רפואיות ותשתיות במשרד הבריאות, המרכזת את הועדה וכן ד"ר אמנון להד, פרופ' משה מיטלמן, מר משה בר סימן טוב, ד"ר ברכה זיסר, ד"ר רחל אדטו, ד"ר זאב אהרונוסון, גב' איריס גינזבורג, ד"ר אנדי וייטמן, פרופ' נועם זוהר, ד"ר חזי לוי, ד"ר ניקי ליברמן, עו"ד יואל ליפשיץ, גב' אתי סממה, גב' רות רלב"ג, ד"ר חגי קדם והרב יובל שרלו. בחודש מרץ 2007 קיבלה התרופה גם את אישור ה – FDA, מינהל המזון והתרופות של ארצות הברית ובעקבות כך הוגשה לרישום בישראל במשרד הבריאות וממתינה לקבלת אישורו.
בחודש דצמבר 2007 השיקה בישראל חברת התרופות גלקסו סמית קליין (GSK) תכנית נגישות, במסגרתה קיבלו עד כה 124 נשים בישראל את התרופה ללא תשלום. עם קבלת אישור סוכנות התרופות האירופית, הודיעה GSK כי כל הנשים ברחבי הארץ, אשר החלו כבר לקבל את התרופה ללא תשלום, ימשיכו לקבלה כל ימי חייהן. בנוסף לכך, עד לאישורה במשרד הבריאות בישראל, תוכלנה חולות נוספות המעוניינות להצטרף לתכנית, לקבל את התרופה ללא תשלום, במרכזים הרפואיים בהם היא פועלת, שיבא בתל השומר, קפלן ברחובות, הדסה בירושלים, רמב"ם בחיפה, המרכז הרפואי תל אביב, המרכז הרפואי רבין בפתח תקוה וסורוקה בבאר שבע.
סרטן השד הינה המחלה הממארת השכיחה ביותר בישראל ובעולם המערבי בכלל. על פי נתוני האגודה למלחמה בסרטן, כ- 4,000 נשים מאובחנות מדי שנה כחולות בסרטן השד. על פי נתוני הלשכה המרכזית לסטטיסטיקה, מדי שנה נפטרות בישראל 954 נשים מסרטן השד. רובן בשל מצב מחלתן המתקדם ואי הטבה מסוגי טיפול אחרים שנוסו. על פי נתוני רישום סרטן לאומי במשרד הבריאות, אחת מכל שמונה נשים בישראל עלולה לחלות בסרטן השד במהלך חייה.
לנוחיותכן, מידע נוסף בנושא באנגלית :
GlaxoSmithKline announced today that the European Commission has granted a conditional marketing authorisation for Tyverb® (lapatinib), the first oral, small molecule dual targeted therapy, for all 27 European Union member states. Lapatinib, in combination with capecitabine, is indicated for the treatment of patients with advanced or metastatic breast cancer whose tumours overexpress ErbB2 (HER2). Patients should have progressive disease following prior therapy, which must include anthracyclines and taxanes, and therapy with trastuzumab in the metastatic setting.
Today’s news means that GSK is able to make lapatinib available in the European Union (subject to market access requirements) and the company is currently working with local regulatory authorities to ensure lapatinib is available to eligible patients as soon as possible.
Lapatinib has a novel mechanism of action that is different from current licensed targeted therapies for ErbB2-positive disease. It is a small molecule that is administered orally and works by getting inside the cancer cell and inhibiting two receptor proteins – the tyrosine kinase components of the ErbB1 and ErbB2 receptors. The signalling of these receptors is responsible for tumour growth and proliferation. ,
"Today’s news will benefit women across Europe with HER2-positiveadvanced or metastatic breast cancer which needs further treatment after the previous standard treatments of anthracyclines, taxanes, and trastuzumab. Lapatinib will play a valuable role in treating this especially aggressive form of advanced breast cancer, with the added benefit of convenience being a pill rather than needing intravenous administration” said Professor David Cameron, Co-Principle Investigator of the Phase III trial (EGF100151) and Director of National Cancer Research Network; Chair, Medical Oncology, Faculty of Medicine and Health, University of Leeds.
"This news signifies a genuine advancement in the treatment of ErbB2-positive breast cancer. These patients are in real need of alternative therapies and we at GSK are proud to make this important new treatment option available to them," said Dr. Paolo Paoletti, SVP and Global Head of the Oncology Medicine Development Centre at GSK. "The authorisation of lapatinib demonstrates our strong commitment to the discovery and development of novel anti-cancer treatments. With numerous clinical trials assessing lapatinib across a range of tumour types, we hope this is just the beginning for this innovative product, in terms of the positive difference it can make to patients’ lives.”
The Data Submitted
The authorisation was based on a pivotal Phase III trial (EGF100151) in which women with locally advanced or metastatic ErbB2-positive breast cancer whose disease had progressed following prior treatment with anthracyclines, taxanes and trastuzumab were given either the combination of lapatinib and capecitabine, or capecitabine alone. The data showed that the investigator assessed median time to progression was 5.5 months (23.9 weeks) in the lapatinib and capecitabine arm versus 4.2 months (18.3 weeks) in the capecitabine arm alone (hazard ratio 0.72; p=0.008).1 The independent assessment demonstrated that lapatinib when given in combination with capecitabine significantly increased time to progression by 6.2 months (27.1 weeks) compared to 4.3 months (18.6 weeks) with capecitabine alone (hazard ratio 0.57 p=0.001).
Central nervous system metastases are a major burden for breast cancer patients. In addition to the achievement of the primary endpoint in the pivotal Phase III trial, results from an unplanned retrospective exploratory analysis demonstrated a reduced incidence of brain metastases as the first site of disease recurrence. In this retrospective exploratory analysis, 2% of patients in the combination arm had relapse to the brain compared with 6% in the capecitabine alone arm.1 These preliminary results with the addition of lapatinib are encouraging and are the basis of ongoing research in this area.
The most common adverse events during therapy with lapatinib plus capecitabine during the pivotal Phase III trial were gastrointestinal (diarrhoea, nausea and vomiting) or skin disorders (rash and hand and foot syndrome).1 Diarrhoea and rash were more common with the combination than with capecitabine alone.4 The majority of adverse events were mild to moderate in severity, and the incidence of grade 3 and 4 events was low and similar in both treatment groups.4 Lapatinib has also been associated with reports of decreases in left ventricular ejection fraction (LVEF), pulmonary toxicity and hepatotoxicity. Advice to doctors is contained in the prescribing information.1
A conditional marketing authorisation is granted to a medicinal product with a positive benefit/risk assessment that fulfils an unmet medical need when the benefit to public health of its immediate availability outweighs the risk inherent in the fact that additional data are still required. A conditional marketing authorisation is renewable annually. As part of the conditions of the conditional marketing authorisation, GSK will provide further data from the pivotal study, and also conduct an additional clinical study.
Future for Lapatinib - Ongoing Clinical Trials
A comprehensive clinical development programme is evaluating lapatinib both alone and in combination with other therapies (chemotherapy, hormonal therapy, other targeted agents and VEGF inhibitors) across the spectrum of ErbB2-positive breast cancer, from metastatic to early breast cancer. Trials are also ongoing and planned in a range of other solid tumours that overexpress ErbB1 and/or ErbB2 including gastric and head and neck cancer.
סוכנות התרופות האירופאית ה- EMEA, אישרה אמש לחברת התרופות גלקסו סמית קליין (GSK) לשווק את טייקרב (Tykerb), תרופה חדשה הניתנת ללקיחה בבליעה לטיפול בסרטן שד מתקדם או גרורתי, בשילוב עם כימותרפיה, ב – 27 מדינות החברות באיחוד האירופי. האישור ניתן בעקבות קבלת תוצאות מעודדות של ניסויים קליניים, שחלקם אף התקיימו בישראל, אשר הראו שיפור בסיכויי הישרדות בחולות סרטן השד. התרופה ניתנת בצורת כדורים והטיפול אינו מצריך אשפוז או עירוי. מדובר בתרופה ביולוגית ממוקדת מטרה, שהחומרים הפעילים בה תוקפים באופן ישיר רק את הקולטנים בתוך התא הסרטני ואינם פועלים על תאים אחרים כמו בטיפול כימותרפי.
בימים הקרובים תוגש התרופה לדיוני הועדה הציבורית להרחבת סל התרופות לשנת 2009, אשר תקציבה עומד על 425 מיליון שקלים וחברים בה פרופ' מנחם פיינרו, המכהן כיו"ר, ד"ר אסנת לוקסנבורג, ראש המינהל לטכנולוגיות רפואיות ותשתיות במשרד הבריאות, המרכזת את הועדה וכן ד"ר אמנון להד, פרופ' משה מיטלמן, מר משה בר סימן טוב, ד"ר ברכה זיסר, ד"ר רחל אדטו, ד"ר זאב אהרונוסון, גב' איריס גינזבורג, ד"ר אנדי וייטמן, פרופ' נועם זוהר, ד"ר חזי לוי, ד"ר ניקי ליברמן, עו"ד יואל ליפשיץ, גב' אתי סממה, גב' רות רלב"ג, ד"ר חגי קדם והרב יובל שרלו. בחודש מרץ 2007 קיבלה התרופה גם את אישור ה – FDA, מינהל המזון והתרופות של ארצות הברית ובעקבות כך הוגשה לרישום בישראל במשרד הבריאות וממתינה לקבלת אישורו.
בחודש דצמבר 2007 השיקה בישראל חברת התרופות גלקסו סמית קליין (GSK) תכנית נגישות, במסגרתה קיבלו עד כה 124 נשים בישראל את התרופה ללא תשלום. עם קבלת אישור סוכנות התרופות האירופית, הודיעה GSK כי כל הנשים ברחבי הארץ, אשר החלו כבר לקבל את התרופה ללא תשלום, ימשיכו לקבלה כל ימי חייהן. בנוסף לכך, עד לאישורה במשרד הבריאות בישראל, תוכלנה חולות נוספות המעוניינות להצטרף לתכנית, לקבל את התרופה ללא תשלום, במרכזים הרפואיים בהם היא פועלת, שיבא בתל השומר, קפלן ברחובות, הדסה בירושלים, רמב"ם בחיפה, המרכז הרפואי תל אביב, המרכז הרפואי רבין בפתח תקוה וסורוקה בבאר שבע.
סרטן השד הינה המחלה הממארת השכיחה ביותר בישראל ובעולם המערבי בכלל. על פי נתוני האגודה למלחמה בסרטן, כ- 4,000 נשים מאובחנות מדי שנה כחולות בסרטן השד. על פי נתוני הלשכה המרכזית לסטטיסטיקה, מדי שנה נפטרות בישראל 954 נשים מסרטן השד. רובן בשל מצב מחלתן המתקדם ואי הטבה מסוגי טיפול אחרים שנוסו. על פי נתוני רישום סרטן לאומי במשרד הבריאות, אחת מכל שמונה נשים בישראל עלולה לחלות בסרטן השד במהלך חייה.
לנוחיותכן, מידע נוסף בנושא באנגלית :
GlaxoSmithKline announced today that the European Commission has granted a conditional marketing authorisation for Tyverb® (lapatinib), the first oral, small molecule dual targeted therapy, for all 27 European Union member states. Lapatinib, in combination with capecitabine, is indicated for the treatment of patients with advanced or metastatic breast cancer whose tumours overexpress ErbB2 (HER2). Patients should have progressive disease following prior therapy, which must include anthracyclines and taxanes, and therapy with trastuzumab in the metastatic setting.
Today’s news means that GSK is able to make lapatinib available in the European Union (subject to market access requirements) and the company is currently working with local regulatory authorities to ensure lapatinib is available to eligible patients as soon as possible.
Lapatinib has a novel mechanism of action that is different from current licensed targeted therapies for ErbB2-positive disease. It is a small molecule that is administered orally and works by getting inside the cancer cell and inhibiting two receptor proteins – the tyrosine kinase components of the ErbB1 and ErbB2 receptors. The signalling of these receptors is responsible for tumour growth and proliferation. ,
"Today’s news will benefit women across Europe with HER2-positiveadvanced or metastatic breast cancer which needs further treatment after the previous standard treatments of anthracyclines, taxanes, and trastuzumab. Lapatinib will play a valuable role in treating this especially aggressive form of advanced breast cancer, with the added benefit of convenience being a pill rather than needing intravenous administration” said Professor David Cameron, Co-Principle Investigator of the Phase III trial (EGF100151) and Director of National Cancer Research Network; Chair, Medical Oncology, Faculty of Medicine and Health, University of Leeds.
"This news signifies a genuine advancement in the treatment of ErbB2-positive breast cancer. These patients are in real need of alternative therapies and we at GSK are proud to make this important new treatment option available to them," said Dr. Paolo Paoletti, SVP and Global Head of the Oncology Medicine Development Centre at GSK. "The authorisation of lapatinib demonstrates our strong commitment to the discovery and development of novel anti-cancer treatments. With numerous clinical trials assessing lapatinib across a range of tumour types, we hope this is just the beginning for this innovative product, in terms of the positive difference it can make to patients’ lives.”
The Data Submitted
The authorisation was based on a pivotal Phase III trial (EGF100151) in which women with locally advanced or metastatic ErbB2-positive breast cancer whose disease had progressed following prior treatment with anthracyclines, taxanes and trastuzumab were given either the combination of lapatinib and capecitabine, or capecitabine alone. The data showed that the investigator assessed median time to progression was 5.5 months (23.9 weeks) in the lapatinib and capecitabine arm versus 4.2 months (18.3 weeks) in the capecitabine arm alone (hazard ratio 0.72; p=0.008).1 The independent assessment demonstrated that lapatinib when given in combination with capecitabine significantly increased time to progression by 6.2 months (27.1 weeks) compared to 4.3 months (18.6 weeks) with capecitabine alone (hazard ratio 0.57 p=0.001).
Central nervous system metastases are a major burden for breast cancer patients. In addition to the achievement of the primary endpoint in the pivotal Phase III trial, results from an unplanned retrospective exploratory analysis demonstrated a reduced incidence of brain metastases as the first site of disease recurrence. In this retrospective exploratory analysis, 2% of patients in the combination arm had relapse to the brain compared with 6% in the capecitabine alone arm.1 These preliminary results with the addition of lapatinib are encouraging and are the basis of ongoing research in this area.
The most common adverse events during therapy with lapatinib plus capecitabine during the pivotal Phase III trial were gastrointestinal (diarrhoea, nausea and vomiting) or skin disorders (rash and hand and foot syndrome).1 Diarrhoea and rash were more common with the combination than with capecitabine alone.4 The majority of adverse events were mild to moderate in severity, and the incidence of grade 3 and 4 events was low and similar in both treatment groups.4 Lapatinib has also been associated with reports of decreases in left ventricular ejection fraction (LVEF), pulmonary toxicity and hepatotoxicity. Advice to doctors is contained in the prescribing information.1
A conditional marketing authorisation is granted to a medicinal product with a positive benefit/risk assessment that fulfils an unmet medical need when the benefit to public health of its immediate availability outweighs the risk inherent in the fact that additional data are still required. A conditional marketing authorisation is renewable annually. As part of the conditions of the conditional marketing authorisation, GSK will provide further data from the pivotal study, and also conduct an additional clinical study.
Future for Lapatinib - Ongoing Clinical Trials
A comprehensive clinical development programme is evaluating lapatinib both alone and in combination with other therapies (chemotherapy, hormonal therapy, other targeted agents and VEGF inhibitors) across the spectrum of ErbB2-positive breast cancer, from metastatic to early breast cancer. Trials are also ongoing and planned in a range of other solid tumours that overexpress ErbB1 and/or ErbB2 including gastric and head and neck cancer.

נוצר:
17/06/2008 00:10:00
עודכן: 17/06/2008 02:35:00
עודכן: 17/06/2008 02:35:00
 גרסה להדפסה גרסה להדפסה |
 שלח לחבר שלח לחבר |

משקאות , יחסים , עינוגים , הריון ולידה , קולנוע